Postado em 14/07/2020

Diretriz prática baseada em evidências para o manejo antitrombótico em pacientes com doença por coronavírus (COVID-19) em 2020
Documento endossado pela Sociedade Brasileira de Trombose e Hemostasia (SBTH), Sociedade Brasileira de Angiologia e Cirurgia Vascular (SBACV), União Internacional de Angiologia (IUA) e Fórum Venoso Europeu (EVF).
Autores
Eduardo Ramacciotti, MD, Ph.D,1,2,3 Ariane Scarlatelli Macedo, MD,2 Rodrigo Bruno Biagioni, MD,4 Renato Delascio Lopes, MD, Ph.D.5, João Carlos Guerra, MD, Ph.D6, Fernanda Andrade Orsi, MD, Ph.D7, Marcos Arêas Marques, MD8,9, Alfonso J. Tafur, MD,10 Cyrillo Carvalheiro Filho, MD, Ph.D,11 Jawed Fareed, Ph.D3
Running Head: Manejo de trombose por COVID-19 com base em evidências
Palavras Chaves: Doença pelo novo coronavírus (2019-nCoV), SARS-CoV-2, trombose, Anticoagulante, Profilaxia, Antiagregantes de Plaquetas
Autor correspondente:
Eduardo Ramacciotti, MD, Ph.D.
Resumo
Esta diretriz prática, endossada pela Sociedade Brasileira de Trombose e Hemostasia (SBTH), Sociedade Brasileira de Angiologia e Cirurgia Vascular (SBACV), União Internacional de Angiologia (IUA) e Fórum Venoso Europeu (EVF), visa fornecer aos médicos uma orientação clara, baseada nos melhores dados atuais, e estratégias clínicas para gerenciar o manejo antitrombótico em pacientes com COVID-19.
Introdução
A infecção causada pelo novo coronavírus 2019 (Sars-COV-2) predispõe os pacientes às complicações trombóticas arteriais e venosas, devido à disfunção endotelial, resposta inflamatória exacerbada, ativação plaquetária e estase venosa. 1,2 Além disso, muitos pacientes que recebem terapia antitrombótica para doença tromboembólica venosa ou arterial podem desenvolver a doença (COVID-19) ou ter sua estratégia de anticoagulação e acompanhamento afetados pela pandemia. 3 Um bom número de diretrizes e documentos foram publicados rapidamente e, infelizmente, dada a natureza urgente da pandemia, muitos propõem estratégias antitrombóticas nunca antes avaliadas. Nesta diretriz prática, revisamos o entendimento atual da patogênese e epidemiologia e propomos uma estratégia de manejo, baseada em evidências, de pacientes com COVID-19 que desenvolvem trombose/tromboembolismo venoso (TEV) ou arterial, naqueles com doença cardiovascular preexistente que desenvolvem COVID-19 ou naqueles que precisam avaliar a sua terapia anticoagulante durante a pandemia de COVID-19. O objetivo desta diretriz é ser o mais prática possível, destacando as lacunas de conhecimento e áreas de incerteza, apoiada em ensaios clínicos randomizados (ECR) e adequadamente conduzidos durante essa pandemia.
O que sabemos sobre a COVID-19
COVID-19 em pacientes sem DCV = ↑ risco de complicações cardiovasculares severas, como cardiomiopatia, acidente vascular cerebral (AVC), trombose venosa ou arterial, infarto agudo do miocárdio (IAM) e morte cardiovascular.
O que não sabemos sobre a COVID-19
Mecanismos trombóticos da COVID-19
Figura 1. A infecção pulmonar e sistêmica de Sars-COV-2
Devido à sua invasão e disfunção endotelial, ativa uma resposta inflamatória, com liberação de mediadores inflamatórios. A ativação endotelial e hemostática ocorre, com diminuição dos níveis de inibidor da via do fator tecidual (TFPI) e aumento do fator tecidual (FT). Essa interação inflamação/coagulação, 4 associada à estase venosa, DCV e genética, alavanca o distúrbio hemostático. 5,6 Isto pode resultar em TEV, particularmente EP, trombose arterial, IAM, AVC e morte cardiovascular e, em caso de mais alterações hemostáticas; coagulação intravascular disseminada (CIVD), cujo tratamento é diferente do PE.
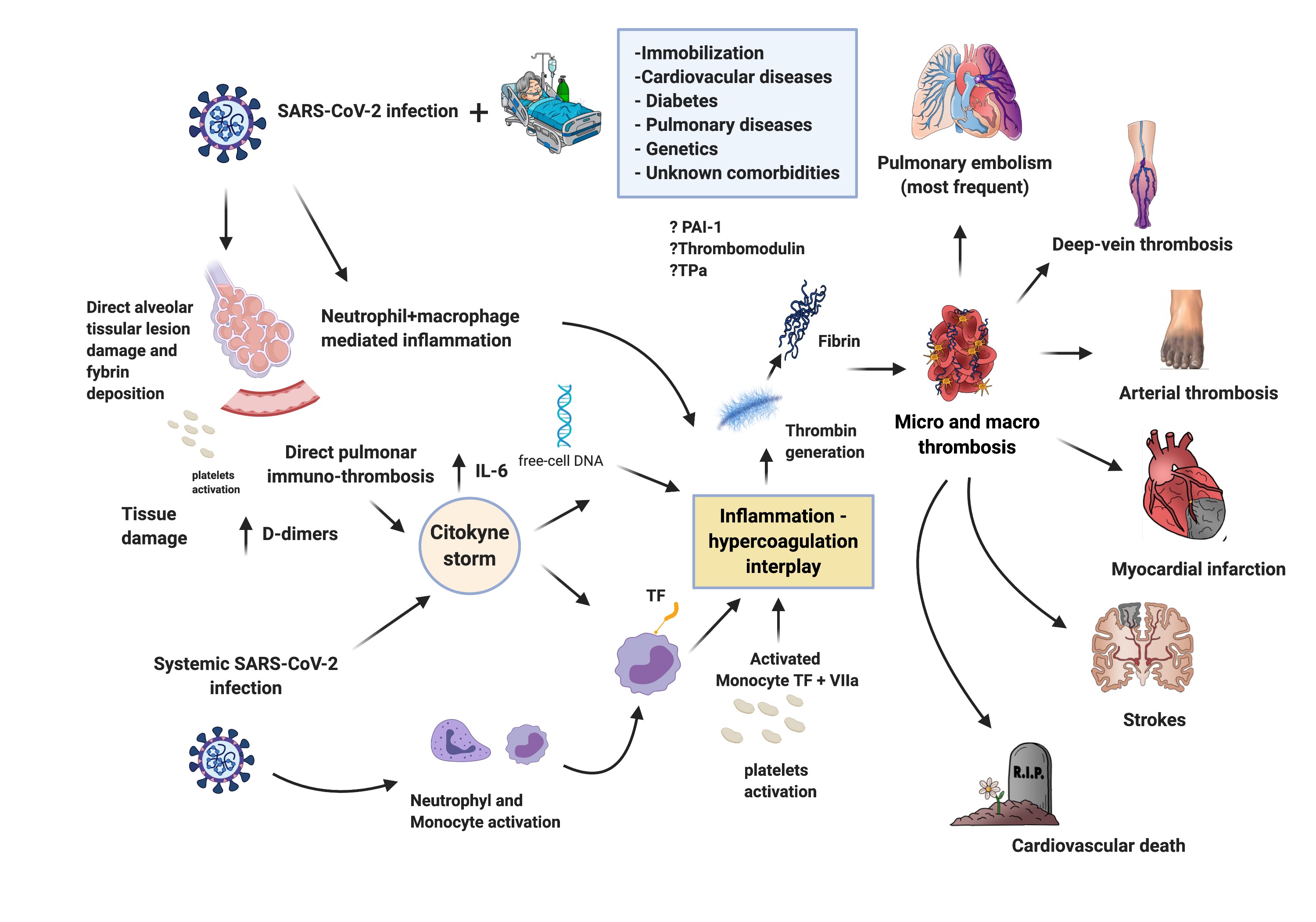
TEV com EP ou trombose pulmonar primária?
Cattaneo e cols., envolvidos no surto de COVID-19 no norte da Itália, relataram uma série de 388 pacientes admitidos em enfermarias, sem nenhum caso de trombose venosa profunda (TVP) sintomática ou assintomática durante a internação. Esse grupo realizou ultrassonografia de compressão de membros inferiores e não conseguiu detectar TVP em nenhum dos 64 pacientes avaliados, independentemente de sua gravidade e do tempo de repouso no leito. 7 Além disso, Klok e cols., relataram 184 casos graves de COVID-19 na Holanda, todos internados em UTI e submetidos à farmacoprofilaxia com doses padrão de heparina de baixo peso molecular (HBPM). Apesar de observada alta incidência de TEV (n=28), apenas um paciente apresentou TVP. 8 Devido a isto, questionou-se se as oclusões observadas e descritas de vasos pulmonares em pacientes com COVID-19 seriam causadas exclusivamente por EP ou por outra patologia trombótica. A análise post mortem sugere microangiopatia trombo-hemorrágica, com dilatação dos vasos sanguíneos pulmonares, contendo microtrombos e material trombótico difuso, fenômenos também observados em outros órgãos. 9 No entanto, a distinção entre as duas patologias não é uma tarefa fácil. Além do mais, suas patogêneses e, portanto, os tratamentos anticoagulantes são indiscutivelmente diferentes.
Figura 2. Incidência muito alta de eventos trombóticos associados à COVID-19.
Os dados epidemiológicos mais atualizados vêm de Klok e cols., que reavaliaram seus achados iniciais e relataram acompanhamento de sete a 14 dias de 184 pacientes internados em UTI, dos quais 41 (22%) morreram e 78 (42%) tiveram alta. Todos pacientes receberam farmacoprofilaxia. A incidência cumulativa do resultado composto, ajustada para competir pelo risco de morte, foi de 49% (intervalo de confiança de 95% [IC] 41-57%). A maioria dos eventos trombóticos foi de EP (65/75; 87%). Os pacientes diagnosticados com complicações trombóticas apresentaram maior risco de morte por todas as causas (HR 5,4; IC 95% 2,4-12). O uso de anticoagulação terapêutica não foi associado à morte por todas as causas (HR 0,79, IC 95% 0,35-1,8). 8
Epidemiologia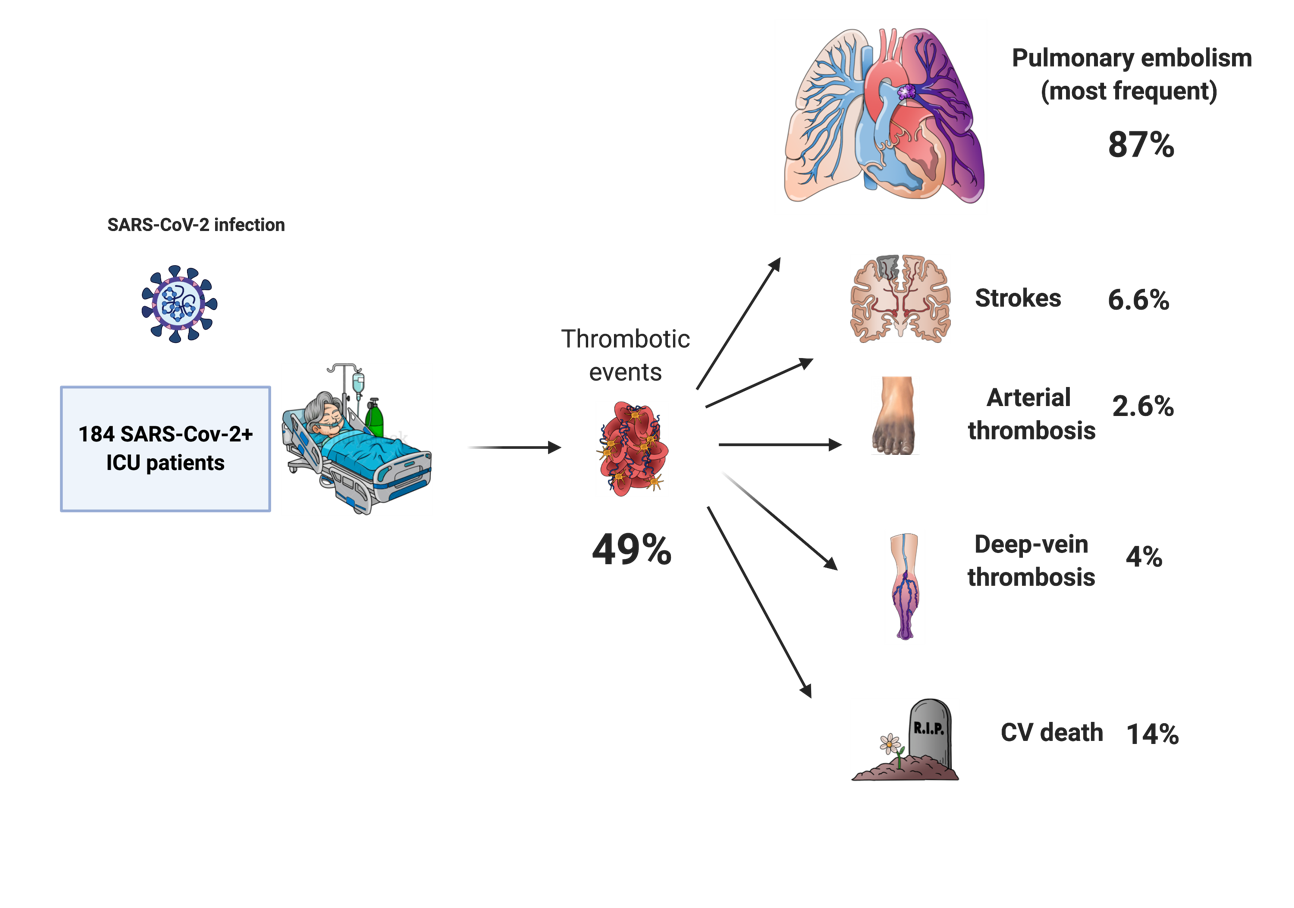
Alterações laboratoriais da COVID-19 10
Anormalidades da coagulação da COVID-19 10
Profilaxia do TEV na COVID-19
Todos os pacientes com COVID-19 devem ser submetidos à estratificação de risco de TEV (com escores de risco validados, como os modelos IMPROVE e Padua) e profilaxia em ambiente hospitalar. 11 O escore de Caprini ainda está em processo de validação para COVID-19. ECRs demonstraram a eficácia da farmacoprofilaxia na redução aguda do risco de TEV em pacientes clínicos hospitalizados, com doses padronizadas e, portanto, o uso adequado da farmacoprofilaxia do TEV foi incorporado às diretrizes da prática clínica. 12 A escolha dos anticoagulantes e suas doses deve basear-se nos melhores dados disponíveis com base em evidências e recomendações das diretrizes internacionais. A declaração provisória de orientação da OMS recomenda HBPM em dose profilática diária ou heparina não fracionada (HNF) subcutânea duas vezes ao dia. 13 Não foram validadas doses aumentadas de anticoagulantes para profilaxia para TEV em pacientes clínicos, em ECR conduzidos adequadamente. Portanto, até o momento, os estudos em andamento não fornecem evidências confiáveis do perfil de segurança e eficácia dessas estratégias. Caso a farmacoprofilaxia seja contraindicada, a profilaxia mecânica do TEV (compressão pneumática intermitente) deve ser considerada em pacientes imobilizados. 12
A profilaxia estendida do TEV deve ser considerada após alta hospitalar. ECRs anteriores, em pacientes hospitalizados com doenças clínicas, demonstraram que a profilaxia estendida com enoxaparina14 ou anticoagulantes orais diretos (DOACs) pode reduzir o risco de TEV, à custa de aumento de eventos hemorrágicos, incluindo sangramentos maiores. 15-17 Curiosamente, foi observado que muitos pacientes com COVID-19 não preenchiam critérios para inclusão no estudo Mariner para extensão de profilaxia em pacientes clínicos. Embora não haja dados específicos da COVID-19, existem ECRs em andamento para essa população de alto risco. Por enquanto, é razoável aplicar uma estratificação de risco trombótico e hemorrágico individualizada, considerando, também, profilaxia estendida (por até 45 dias) para pacientes com risco elevado de TEV e baixo risco de sangramento. 18
Recomendações para a profilaxia do TEV
Recomendações da declaração provisória da OMS
* Ajustar a dose de enoxaparina para 20 mg SC em dose única diária se ClCr <30ml/min
Figura 3. Doses de farmacoprofilaxia do TEV em pacientes internados por COVID-19. 19
Figura 4. Estratégias e dose de extensão da farmacoprofilaxia de TEV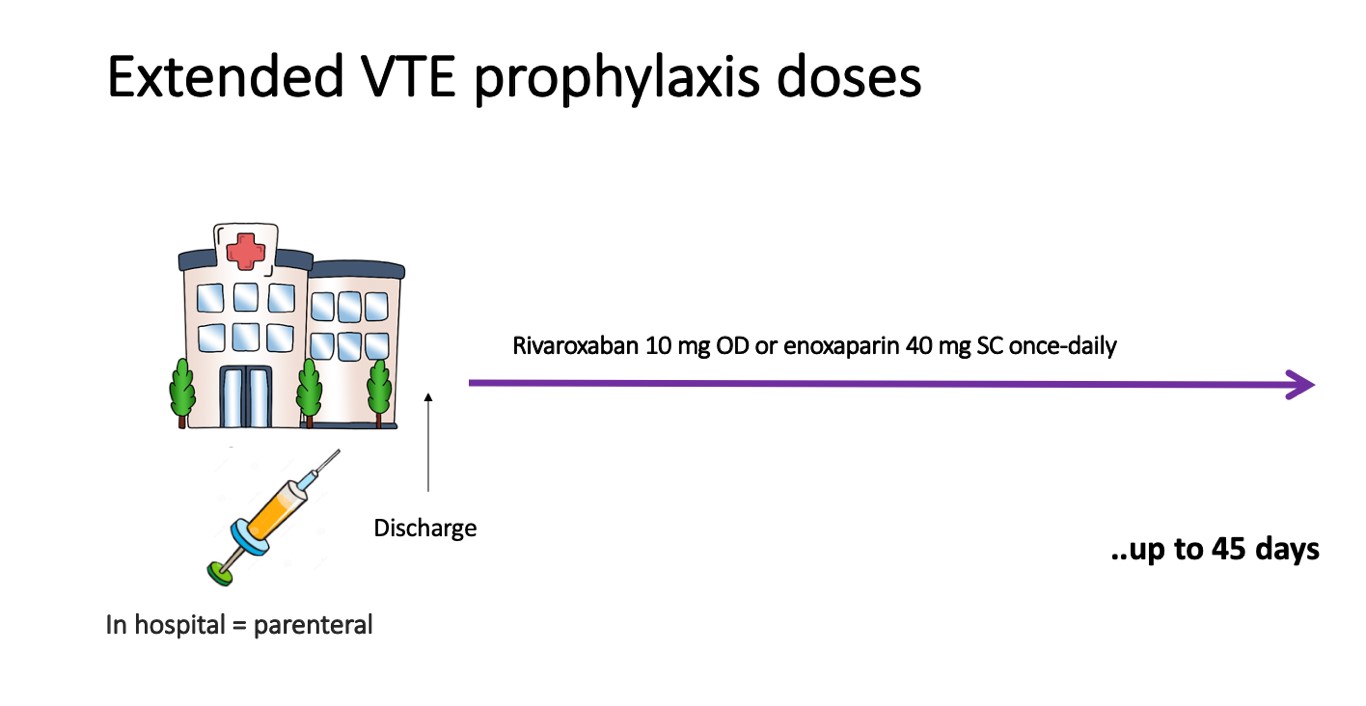
Tratamento do TEV associado à COVID-19
A anticoagulação é o cerne do tratamento do TEV, 20 e doses padronizadas devem ser usadas até que mais dados surjam dos ECRs em andamento. Até o momento, temos poucos dados disponíveis que sustentem menor mortalidade por uso rotineiro de outras estratégias no TEV, como terapia fibrinolítica ou inserções de filtros de veia cava. 21 A duração da anticoagulação deve ser definida em um cenário individualizado, mas dada a frequência e gravidade dos eventos trombóticos associados ao COVID-19, em combinação com comorbidades clínicas, é razoável pensar em terapias estendidas de anticoagulação. 22
Tratamento
* ClCr <30ml/min = 1mg/kg (dose única diária).
** IMC (kg/m2): 30-40 (40-60 mg/dia), 40-50 (40 mg 12/12h) e >50 (60 mg 12/12h).
Figura 5. Doses de anticoagulação do TEV em pacientes internados por COVID-19.19
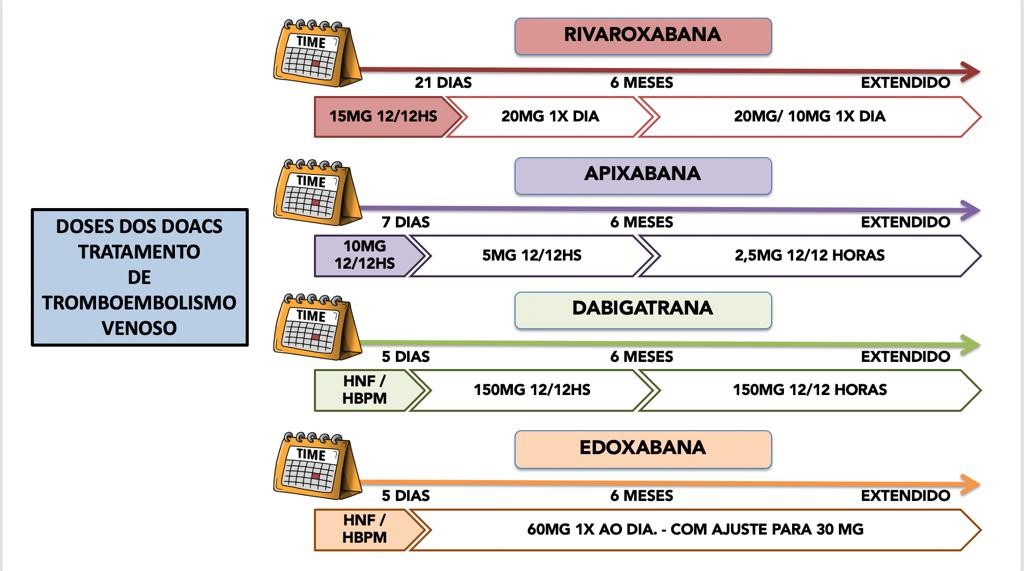
Figura 6. Doses de anticoagulação dos DOACs para pacientes com COVID-19 e TEV. 23
Anticoagulação terapêutica empírica na pandemia
A COVID-19 é uma infecção viral agressiva, com poucos dados confiáveis sobre sua morbimortalidade cardiovascular. Os relatos sugerem altas taxas de eventos trombóticos arteriais e venosos graves, 8 e por isto, alguns médicos sugerem anticoagulação parenteral em dose intermediária ou plena ao invés da profilática, no atendimento de rotina de pacientes com COVID-19, na hipótese de que poderia conferir um benefício na profilaxia da trombose microvascular, mesmo na ausência de suspeita de trombose.21 Porém, os dados existentes são muito limitados, e baseados principalmente em uma análise de subgrupo (N=97) de um único estudo retrospectivo com ajustes limitados. 24 Atualmente, não é possível avaliar o perfil de segurança/eficácia de tais estratégias. ECRs adequados estão em andamento e fornecerão orientações importantes sobre as melhores estratégias anticoagulantes no tratamento da trombose por COVID-19.
ECRs de estratégias de anticoagulação na COVID-19 em curso
Até o momento, existem 40 estudos e ECRs programados para avaliação de diferentes estratégias de anticoagulação para o manejo de trombose relacionado à COVID-19 registrados em www.clinicaltrials.gov. A Tabela 1 mostra esses estudos/ECRs até 30 de abril de 2020.
Considerações finais
Dada à inesperada pandemia de COVID-19, com taxas surpreendentemente altas de tromboses arteriais e venosas, é compreensível que os médicos da linha de frente decidam ampliar os limites das indicações de tratamento conhecidas, baseados em suas opiniões e experiências. Não sabemos quando essa pandemia terminará e a comunidade científica do mundo todo tem trabalhado duro para produzir evidências adequadas para orientar a prática clínica e melhorar o atendimento ao paciente. O sofrimento causado pela pandemia não concede liberdade para escolhermos quaisquer estratégias de anticoagulação, baseadas apenas em experiências pessoais. Observações clínicas e bom senso, combinados com equilíbrio, em diferentes intervenções, devem ser usados para gerar hipóteses a serem testadas prospectivamente em ECRs. O ECR é a abordagem mais confiável para avaliar os resultados de novos tratamentos e vacinas. 25 Durante a epidemia de Ebola na África Ocidental (2014–2015), muitos questionaram se os ECRs seriam viáveis. Pesquisadores experientes demonstraram que os ECRs, mesmo em circunstâncias tão difíceis, não só foram viáveis, como foi a única maneira confiável de fornecer orientação adequada, em contraste com as estratégias empíricas empregadas durante a pandemia. 26
No momento, muitos estudos diferentes, avaliando anticoagulantes e outras estratégias para a profilaxia e tratamento do TEV, estão em andamento. Dados confiáveis estarão disponíveis em breve, mas até então, os médicos devem fazer o que foi comprovadamente eficiente e seguro e, em caso de incerteza, randomizar os pacientes em ensaios clínicos em andamento.
|
|
Title and hyperlink |
Population |
Intervention |
Main outcomes |
|
NCT 04377997 |
Safety and Efficacy of Therapeutic Anticoagulation on Clinical Outcomes in Hospitalized Patients With COVID-19 |
300 adult COVID-19 patients hospitalized in ICU with Elevated DD (>1.5g/mL at admission |
Enoxaparin |
1) Composite efficacy endpoint of death, cardiac arrest, symptomatic deep venous thrombosis, pulmonary embolism, arterial thromboembolism, myocardial infarction, or hemodynamic shock. [Time Frame: 12 weeks] 2) Major bleeding event according ISTH definition. [Time Frame: 12 weeks]
|
|
NCT 04373707 |
Weight-Adjusted vs Fixed Low Doses of Low Molecular Weight Heparin For Venous Thromboembolism Prevention in COVID-19 |
602 Adult patients hospitalized for a probable/confirmed COVID-19 infection
|
Enoxaparin |
Risk of deep vein thrombosis or pulmonary embolism or venous thromboembolism-related death [ Time Frame: 28 days]
|
|
NCT 04372589 |
Antithrombotic Therapy to Ameliorate Complications of COVID-19 ( ATTACC ) |
3000 adult patients hospitalized for confirmed COVID-19
|
Heparin |
Intubation (Any need for invasive mechanical ventilation) 2.Mortality [Time Frame: 30 days]
|
|
NCT 04367831 |
Intermediate or Prophylactic-Dose Anticoagulation for Venous or Arterial Thromboembolism in Severe COVID-19 |
100 patients with Confirmed diagnosis of COVID-19 hospitalized in the ICU
|
Enoxaparin Prophylactic Dose Heparin Infusion Heparin SC Enoxaparin/ Intermediate Dose
|
Number of Patients with Clinically Relevant Venous or Arterial Thrombotic Events in ICU [Time Frame: Discharge ICU or 30 days]
|
|
NCT 04366960 |
Comparison of Two Doses of Enoxaparin for Thromboprophylaxis in Hospitalized COVID-19 Patients |
2712 patients hospitalized with confirmed COVID-19
|
Drug: Enoxaparin |
Incidence of venous thromboembolism detected by imaging [Time Frame: 30 days]
|
|
NCT 04362085 |
Coagulopathy of COVID-19: A Pragmatic Randomized Controlled Trial of Therapeutic Anticoagulation Versus Standard Care |
462 patients hospitalized with confirmed COVID-19 and DD value ≥2 times ULN
|
Drug: Therapeutic Anticoagulation |
ICU admission, non-invasive positive pressure ventilation, invasive mechanical ventilation or all-cause death [Time Frame: up to 28 days]
|
|
NCT04360824 |
170 patients hospitalized with confirmed COVID-19 with a modified ISTH Overt DIC score ≥ 3
|
Intermediate dose Enoxaparin SoC thromboprophylaxis
|
All-Cause Mortality [Time Frame: 30 Days] Risk of all-cause mortality
|
|
|
NCT 04359277 |
A Randomized Trial of Anticoagulation Strategies in COVID-19 |
1000 COVID-19 positive patients with a DD >500 ng/ml. |
Drug: Enoxaparin Higher Dose Drug: Lower-dose prophylactic anticoagulation |
1)All-cause mortality [Time Frame: 1 year] 2) Incidence of Cardiac Arrest, symptomatic Deep Venous Thrombosis and Pulmonary Embolism, Arterial thromboembolism, myocardial infarction and hemodynamic shock [Time Frame: 21 days]
|
|
NCT 04359212 |
Increased Risk of VTE and Higher Hypercoagulability in Patients Recovered in ICU and in Medical Ward for COVID-19 |
90 patients with a confirmed infection for COVID-1 needing admission to a medical hospital division or to an ICU
|
|
Cumulative proportion of any distal or proximal deep venous thrombosis or of symptomatic pulmonary embolism [ Time Frame: 28 days]
|
|
NCT 04345848 |
Preventing COVID-19 Complications With Low- and High- dose Anticoagulation |
200 adult patients with COVID-19 infections, admitted to an acute non-critical medical ward with admission DD levels >1,000ng/mL, or an acute critical ward (ICU, intermediate care unit)
|
Drug: Enoxaparin |
Composite outcome of arterial or venous thrombosis, disseminated intravascular coagulation and all-cause mortality [Time Frame: 30 days]
|
|
NCT 04344756 |
Trial Evaluating Efficacy and Safety of Anticoagulation in Patients With COVID-19 Infection, Nested in the Corimmuno-19 Cohort |
Non reported |
•Drug: Tinzaparin or unfractionated heparin |
Non-reproted |
Tabela 1. Ensaios intervencionistas em andamento sobre o tratamento de TEV em pacientes com COVID-19
Referências